
7번 문제는 사람의 몸과 지각의 구성요소에 대한 문제입니다.
가)는 사람의 몸이고, (ㄱ)는 지각의 구성요소이다.
사람의 몸에 가장 많은 것이 물입니다.
물은 수소와 산소로 구성되어 있습니다.
그리고 지각에서 가장 많은 원소는 산소입니다.
두 번째로 많은 것이 실리콘입니다.
그래서 X와 Z는 산소와 규소입니다.
사람의 몸에서 가장 많은 것은 물이라고, 두 번째로 많은 것은 단백질입니다.
그렇다면 Y는 무엇인가? 바로 질소입니다.
질소의 원자번호는 7번이고 실리콘은 14번입니다.
ㄷ에서 최대 4개의 다른 원자와 공유결합이 가능한 원소는 탄소이다.
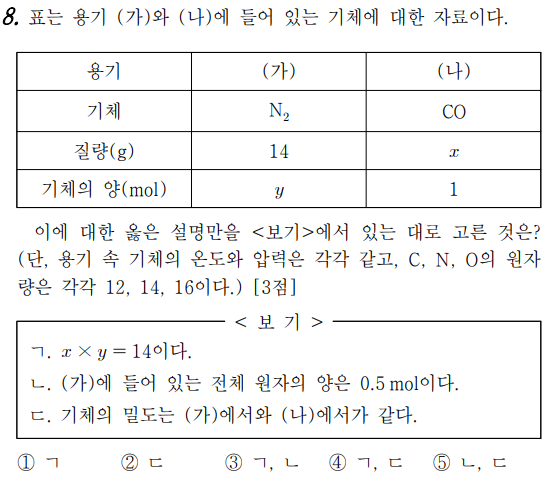
8번 문제는 기체의 양을 몰로 표현한 문제다.
1몰은 기체 6.02×10^23개를 묶은 단위입니다만, 질량은 물질의 화학량에 g를 붙이면 됩니다.
예를 들어 H 1 몰이 있다고 가정합니다.
그럼, 수소 1몰에는 수소 원자가 몇개인가? 정확히 6.02×10^23개 있어 기체의 부피는 22.4L를 말합니다.
나)는 질소 분자군요. 질량이 14g군요. 질소 원자의 원자량이 14이므로 질소 분자는 질소 원자 2개가 모인 것입니다.
그런 다음 질소 분자의 분자량은 질소 원자의 두 원자량의 합계이므로 28입니다.
그러면 1몰의 질소 분자의 질량은 28g이 됩니다.
그런데 문제로 14g이었기 때문에 현재 질소 분자는 1몰이 아니라 0.5mol(몰)이 들어 있는 것입니다.
나)는 일산화탄소군요. CO이므로 탄소 원자 1개와 산소 원자 1개가 모여 있기 때문에 분자량은 탄소 원자 1개의 원자량 12+ 산소 원자 1개의 원자량 16=28이며, 기체의 양이 1mol이었기 때문에 질량은 28g이 있습니다.
밀도는 어떻게 구합니까? 질량/체적으로 구합니다.
하지만 부피를 모르겠습니까? 그러나 몰수를 통해 체적을 구할 수 있습니다.
위에서 1몰의 부피는 22.4L라고 말했다.
그렇다면 0.5mol의 부피는 2/22.4L로 계산하면 되므로 11.2L라고 하면 됩니다.
따라서 (a)의 밀도는 14g/11.2L이고, (a)의 밀도는 28g/22.4L이다.
그럼 대답은 알았어요~~
– 문제로 몰이라고 했는데 제가 한글에서 몰이라고 말해 영어로 몰도 사용했습니다.
둘 다 같은 말입니다^^-
-- 디스플레이수평형반응 -->
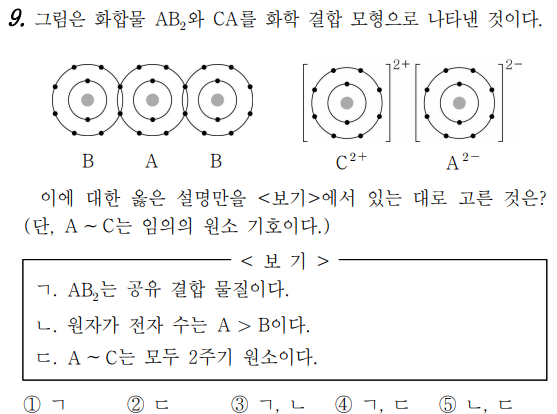
9번 문제는 화합 결합에 관한 문제입니다.
화합물 결합은 이온 결합, 공유 결합, 금속 결합이 있지만, 이온 결합은 양이온과 음이온이 결합하는 것이며, 공유 결합은 비금속끼리 전자를 공유하는 결합이다.
그리고 금속 결합은 금속을 형성하는 데 사용되는 결합입니다.
문제로 BAB는 서로 전자를 공유하고 있어 C와 A는 이온으로서 존재하면서 결합하고 있기 때문에 이온 결합이군요.
원자가전자수란 가장 바깥쪽에 포함되는 전자수를 말합니다.
각 원소를 보십니까? A는 2가 음이온이다.
전자 2개를 받아 음이온이 되면, 원래 원자가 가지는 전자수는 이온일 때 총 전자수로부터 2개를 빼는 것만으로 된다.
따라서, 원자 A의 전자수는 8개이고, 원자일 때 전자수는 양성자수와 같고 양성자수가 8의 산소이며, C는 2가 양이온이므로 원자 C의 전자수는 이온의 전자수로부터 2개를 더하면 되므로 원자일 때 전자수는 12개이다.
따라서 양성자 수도 12개이므로 원자 번호는 12번 마그네슘(Mg)이다.
그렇다면 원자 B는 무엇입니까?
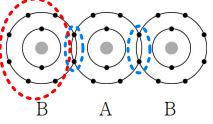
파란 부분의 전자를 공유 전자라고합니다.
서로 전자를 하나씩 주어 만들어서 공유 전자쌍이라고 합니다.
그렇다면 원자 B의 원자가 전자 수는 몇 개입니까? 세어 보면 알겠지만, 7개입니다.
붉은 부분의 전자 6개와 청색 부분 전자 1개가 원자 B가 가지고 있던 전자라고 볼 수 있습니다.
그럼, 원자 B의 총 전자수는 9개로, 양자수도 9개이므로, 원자 번호는 9번의 F(플루올린)군요.
답은 스스로 찾아주세요^^

10번 문제는 금속나트륨(Na)의 성질에 관한 문제입니다.
금속은 보통 은백색의 광택이 나타나 수소보다 반응성이 크기 때문에 물과 반응하면 수소가스가 발생합니다.
(그러나 모든 금속은 아닙니다 ^^), 도전성과 열을 잘 전합니다.
그리고 전성과 연성의 성격을 가지고 있습니다.
나) 은백색의 광택이 사라지는 이유는 산소와 반응하기 때문입니다.
c) 물과 나트륨이 반응하면, 수중의 수소이온이 수소가스가 되어, 수산화이온(OH-)이 수용액에 남아 있습니다만, 이 수산화이온 때문에 수용액의 액성은 염기성이 됩니다.
그래서 페놀프탈레인 용액을 만나면 빨간색으로 바뀝니다.
왜? 페놀프탈레인 용액은 염기성을 만나면 적색이 되기 때문입니다^^(참고에 페놀프탈레인 용액은 산이나 중성에서는 무색을 띠고 있습니다^^)
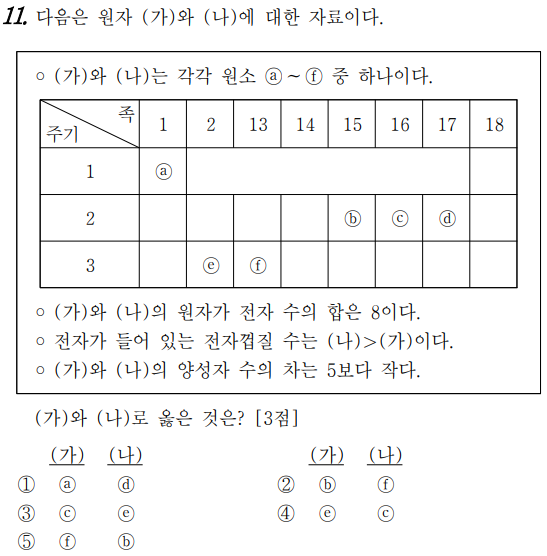
11번의 문제는 주기율표에 관한 문제입니다.
가)와 나)는 원소 a~f의 하나입니다만, 언뜻 보면, 강내의 원자가 전자수의 합계는 8입니다.
원자가전자수는 1에서 7까지이며, 18족 원소는 원자가전자수가 0입니다^^. 그래서 원자가 전자의 수를 쉽게 확인하는 방법은 발에서 작업 단위가 그 원소의 원자가 전자로 볼 수 있습니다.
a는 1족이므로 원자가전자수는 1개, d는 17족이므로 원자가전자수는 7개입니다.
강내의 원자가전자수의 합계가 8이었기 때문에 가능한 원자는 a와 d, e와 c, f와 b만 가능하다.
둘째, 전자가 들어있는 전자 껍질 수는 나>로 했으므로, 전자 껍질 수는 주기로 확인이 가능합니다.
1주기라면 전자 껍질 수는 1개, 2주기라면 전자 껍질 수는 2개, 3주기이면 전자 껍질 수는 3개입니다^^ 절대로 a가 될 수 없네요. 그래서 가능한 조합은 c와 e, b와 f입니다.
셋째, 강내의 양자수의 차이는 5보다 작다고 했으므로, c와 e로 c의 양자수는 8개, e의 양자수는 12개군요. b의 프로톤수는 7개, f의 프로톤수는 13개이므로, 강내의 프로톤수의 차이가 5 이하는 c와 e이다.
이렇게 해결하는 방법이 있으며,
만약 내가 주기율표를 암기하고 있다면 a~f까지 원소명을 적는 방법도 있습니다.
a는 수소, b는 질소, c는 산소, d는 플루오린, e는 마그네슘, f는 알루미늄이다.
그러면 원자 번호는 1, 7, 8, 9, 12, 13(순차적으로)이므로, 프로톤수의 차이가 5 이하를 찾는 것도 하나의 방법이다.
답은 스스로 찾아주세요^^
이상 11회까지 모의 시험 해설이었습니다.
구독, 심장, 광고는 나에게 큰 도움이 될 것입니다.
^^
